一、药品批准生产上市情况
2011年,共批准药品注册申请718件。其中批准境内药品注册申请644件,批准进口74件。 在644件境内药品注册申请中,化学药品569件,占88.4%;中药50件,占7.8%;生物制品25件,占3.8%。 从注册分类看,境内药品注册申请中,新药149件,占22.9%;改剂型59件,占9.3%;仿制药436件,占67.7%。与2010年相比较,批准化学药品仿制药品的数量减少,批准新药的数量增加,其中,1.1类化学药品共批准10件,相比2009年及2010年有显著增长。
表1 2011年批准的药品情况 注册分类 | 新药 | 改剂型 | 仿制药 | 进口药 | 合计 | 化学药品 | 103 | 35 | 431 | 68 | 637 | 中 药 | 21 | 24 | 5 | 2 | 52 | 生物制品 | 25 | 4 | 29 | 合 计 | 718 |
注:1. 表中数据以受理号计,受理号系申请人提出的一件申请事项的编号。对各申请企业的原料药、制剂、制剂不同规格分别予以编号。
2. 表中新药系根据《药品注册管理办法》规定按照新药管理的药品。化学药品新药包括化学药品注册分类1-4,中药新药包括中药、天然药物注册分类1-7。
3. 表中化学药品改剂型为化学药品注册分类5,中药改剂型为中药、天然药物注册分类8。
4. 表中化学药品仿制药为化学药品注册分类6,中药仿制药为中药、天然药物注册分类9。
5. 生物制品不进行分类。
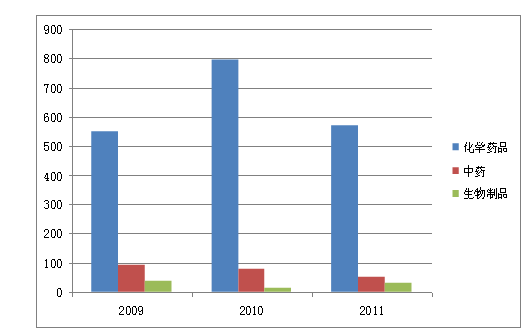
图1 2009~2011年批准国产药品的对比
表2 2011年批准的化学药品新药分布 注册类别 | 1.1 | 1.5 | 2 | 3.1 | 3.2 | 3.3 | 3.4 | 4 | 其他 | 批准数量 | 10 | 1 | 2 | 49 | 17 | 2 | 2 | 1 | 19 | 合 计:103 |
注:“其他”指按《药品注册管理办法》(2005年版)分类申报的一、二、三、四类药品。数量以受理号计。
表3 2011年批准的中药新药分布 注:“其他”指按《药品注册管理办法》(2005年版)分类申报的三类药品。数量以受理号计。
表4 2011年批准的1.1类新药 药品名称 | 注册类别 | 剂 型 | 生产企业 | 艾瑞昔布 | 化药1.1类 | 原料药 | 江苏恒瑞医药股份有限公司 | 艾瑞昔布片 | 化药1.1类 | 片剂 | 江苏恒瑞医药股份有限公司 | 盐酸埃克替尼 | 化药1.1类 | 原料药 | 浙江贝达药业有限公司 | 盐酸埃克替尼片 | 化药1.1类 | 片剂 | 浙江贝达药业有限公司 | 艾拉莫德 | 化药1.1类 | 原料药 | 先声药业有限公司 | 艾拉莫德片 | 化药1.1类 | 片剂 | 先声药业有限公司 | 吡非尼酮 | 化药1.1类 | 原料药 | 上海睿星基因技术有限公司 | 吡非尼酮胶囊 | 化药1.1类 | 胶囊剂 | 上海睿星基因技术有限公司 | 托伐普坦片 | 化药1.1类 | 片剂 | 浙江大冢制药有限公司 | 托伐普坦片 | 化药1.1类 | 片剂 | 浙江大冢制药有限公司 |
二、药物临床研究批准情况
2011年,共批准621个注册申请开展临床研究。其中39个为注册分类1类的化学药品注册申请,110件为国际多中心临床研究申请。批准进入临床试验的药物,既涵盖在我国疾病谱中占重要位置的常见疾病和多发疾病,如肿瘤、心血管病等的治疗药物,也包括了社会影响度高的一些罕见性疾病的治疗药物。对于符合《新药注册特殊审批管理规定》要求的,按照特殊审批程序开展审评审批,促进药物研究进程。
表5 2011年药物临床研究批准情况 注册分类 | 临床试验 | 生物等效性试验 | 合 计 | 化学药品 | 359 | 124 | 483 | 中 药 | 54 | / | 54 | 生物制品 | 84 | / | 84 | 总 计 | 621 |
注:以受理号计 三、注册申请受理情况 2011年,国家局共受理药品新注册申请3620件,其中境内药品注册申请2913件,进口药品注册申请707件。在2913件境内药品注册申请中,新药1078件,占37.0%;改剂型169件,占5.8%;仿制药1666件,占57.2%。与2010年相比,境内新注册申请量增加20%,新药申报量与2010年相比略有增加,改剂型及仿制药申报量与2010年相比增加34%。
表6 2011年药品新注册受理情况表
|